
E05 为何汤姆·克鲁斯60岁还能拍动作片?如何让衰老变慢♾️ Jan Gruber: 衰老时钟的设计、解释与应用 | 他山之石



欢迎收听不朽真龙博客,我们是一家投资长生不老领域的使命驱动基金,投资之外,我们出版翻译书籍、资助行业会议和学术机构,制作播客和媒体内容,从而支持抗衰科学研究,布道续命理念信仰。
你现在收听的是他山之石系列节目,我们通过翻译与 AI 语音克隆,让全世界的科学家和思想者用中文为你讲述最前沿的longevity技术与理念。本系列由不朽真龙团队制作,内容已获授权,对其中学术观点保持中立。
本期他山之石的嘉宾是 Jan Gruber,在这场演讲中,他将用一个简单的物理学模型解释衰老时钟的原理。为什么有些人老得更快,有些人老得更慢?并展示如何构建出能够准确预测未来 20 年死亡风险的时钟模型。
大家好,非常感谢邀请我作为本环节的首位演讲者。基于我是第一位发言,我决定从更宽泛的角度谈谈生物年龄时钟,而不仅仅聚焦于我们开发的某一个特定时钟。
如果您对某个特定时钟感兴趣,我们也准备了相关海报,上面有更多数据和详细信息,欢迎查阅。
01:32📍 市面上已经有太多生物年龄时钟,为什么我们还要开发另一个?揭示衰老干预的真正目标
我想先提出一个问题,为什么我们要研发生物年龄时钟?为什么还需要另一种时钟?我知道有些人认为已经有太多生物年龄时钟了,似乎只要挑选一个你喜欢的,就能确定自己的生物年龄。
那么,为什么还要继续开发生物年龄时钟呢?
其中一个答案要追溯到我多年前的研究。当初创建研究小组时,我个人做了大量工作,主要研究无脊椎动物的衰老模型。现在我的实验室仍在继续这方面的研究。
接下来我想给大家展示一张关于秀丽隐杆线虫的幻灯片。
这些线虫的最长寿命大约是30天左右。
如果您观察一组28天年龄的线虫样本,通过显微镜看到的情况就是这样的。
这里有一段28天年龄的线虫的小视频。你可以看到,大部分线虫已经死亡了。
因为到这个年龄,大约80%的线虫都会死亡。
还有一些顽强的小家伙仍在努力坚持着生命,但它们已经病了。
它们无法正常移动,还出现了排便困难。如果它们能够表达意见,肯定会说此时的生活已经毫无乐趣可言。不过,它们只有300个神经元,所以也产生不了太多复杂想法。
再看看我们实验室进行的药物协同作用研究中的干预效果。当我们观察同样的线虫,确切来说,是那些接受了药物组合治疗的成年线虫的兄弟姐妹,会发现在相同年龄下,它们的状态完全不同。
我展示这个例子是想直观地说明,当我们谈论衰老干预时,并不是在讨论如何让生物在衰弱状态下多活几天。
这实际上是关于如何让生物保持更长时间的年轻状态,或者说重返年轻,取决于你认同哪种理论观点。显然,这些经过干预的线虫在各个生物学层面上,都比未经干预的同类年轻得多。
当然,有人会说:"好吧,这只是线虫,只是简单的模式生物和无脊椎动物,与人类没有可比性。"
03:24📍 汤姆·克鲁斯 vs 瓦尔·基尔默:为什么同龄人会在40年后判若两人?
但如果你看看这两位,1986年的汤姆·克鲁斯和瓦尔·基尔默,他们当时非常相似。那时他们都是年轻的演员,非常成功,在很多方面都处于事业的起步阶段。从生物学和年龄角度来说,他们当时非常接近。
然而,在接下来的40年里,他们的衰老轨迹却截然不同。造成这种差异的原因很多也很复杂:有生活方式的不同,有运气因素,有环境影响,有基因差异,还有各种各样的其他因素。但毫无疑问,他们的衰老过程完全不同。顺便说一句,意识到这部电影已经是将近40年前的事了,让我感觉自己也老了不少。
总之,这40年中,他们经历了截然不同的变化过程,衰老轨迹已经大大分叉。由此可见,在所有动物中,包括人类,生物学年龄与实际年龄确实有很大差异。因此,了解一个个体的生物学年龄,并搞清楚哪些因素决定你处于衰老轨迹的哪个位置,变得尤为重要。这就是为什么我认为,生物年龄时钟对于开发抗衰干预措施至关重要。
那么,我们该如何开发这些生物年龄时钟呢?首先必须思考,你究竟想要测量什么样的生物学年龄。我们要针对哪种生物学年龄,哪种衰老过程?我认为,对于未来这些生物年龄时钟的融合,非常重要的一点是,应该减少关注一个人在特定特征上的表现,而是本质上聚焦于死亡风险。
04:48📍 戈姆佩茨定律的数学魅力:为什么人类死亡风险每八年翻倍?
这就引出了我要介绍的人物,维多利亚时代的精算师本杰明·戈姆佩茨。
他发现了一个重要规律:人类的死亡风险每八年就会翻一倍。看这个公式,这是死亡风险,这是年龄。对于人类来说,死亡风险与年龄的关系可以表示为2的(年龄除以8)次方。
这是公式作为曲线的样子。去年在同一个会议上,安德鲁·斯蒂尔告诉我们不要用对数坐标来展示这个图表。所以我回去重新设计了整个幻灯片,使用非对数刻度,这样大家可以直观地看到死亡风险的指数级增长。横轴是年龄,纵轴是死亡风险。
你可以看到,在10岁时,你在一年内的死亡风险大约是万分之一。八年后,这个风险翻倍。到了40岁,风险增加到约六百分之一。到了60岁,每年的风险约为百分之一。而到了80岁,风险已经达到约二十分之一。这是相当陡峭的风险增长曲线,你可以看出人类寿命很快就会碰到一道天花板。
但重要的是,个体因为各种因素,生活方式、药物、基因、环境等,可能会有略微不同的死亡风险翻倍时间,而这些微小差异会产生相当大的影响。假设我们把翻倍时间改为10年,这实际上只是衰老速率慢了约20%,那么基本上一个80岁的人就会拥有与普通曲线上60岁的人相同的死亡风险。
这样我们就可以说,这个80岁的人实际上拥有60岁的生物学年龄。这正是我们用于生物年龄时钟的死亡风险定义或年龄定义。它衡量的是你的死亡风险与参考人群中某个特定年龄的风险相当,而不是你看起来像参考人群中的某个年龄段。所以,这是一种以死亡风险为结果的衡量方式。
说到这,人们常常会问:好的,但我们不是都在关注健康寿命吗?为什么你一直在谈论死亡风险?为什么我们要制作死亡风险时钟,而不是健康寿命时钟?
但实际上,人类并不是因为某种神奇的"衰老魔咒"而死亡的,他们不会在完全健康的状态下突然因为寿命耗尽就离世。他们死亡的真正原因是身体恢复力的下降。换句话说,那些不足以夺走年轻人生命的挑战,可能却足以让老年人丧命,因为老年人的恢复力较低。新冠病毒就是一个很好的例子,它在很大程度上导致了更多老年人死亡。
当然还有一点,人们会死于与年龄相关的疾病,而这些疾病本身就是导致死亡的原因。
因此,这种死亡风险时钟自然也会追踪死亡率。我的意思是,通过追踪死亡率,我们也能同步追踪身体机能和恢复力的下降情况。这三者之间是紧密关联的。
所以,我认为基于死亡风险数据进行训练是一个很好的方向,因为这通常是我们能获得的最佳数据。相比之下,获取纵向数据要困难得多。比如,在大型数据集中收集日常生活数据是一个很好的方法。这是一张关于新加坡的幻灯片。
我们有一个项目,叫做健康长寿转化研究计划。这个项目的核心任务是基于各种组学标记物,包括生物衰老时钟,利用它们来识别有效的干预措施。然后,我们通过较短周期的临床试验来不断优化这些干预措施,利用生物时钟来指导干预方案的开发和测试,并不断循环这个过程,直到找到能够有效降低生物衰老速率、延长健康寿命的方法,可能是生活方式调整、药物干预、饮食改变或其他任何有效模式。这就是我们研究计划的主要目的。
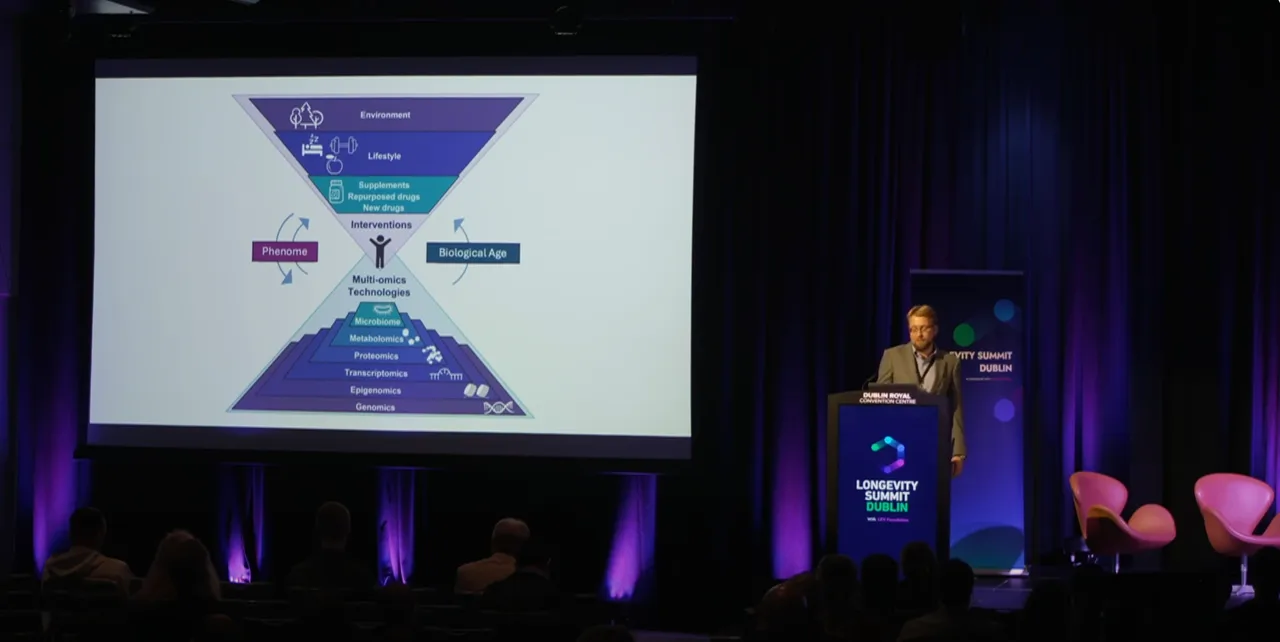
我在这里展示了整个金字塔结构,你可能会问:好的,你在开发表观遗传时钟,那你是否也在开发像Max提到的脂质时钟?或者蛋白质组时钟?我应该使用哪一种?
我的回答是:选择最便捷的、你有数据支持的、你认为最具信息价值的那一种。因为实际上,你应该能够从任何一种特征空间得到基本相同的答案。
08:39📍物理学家眼中的衰老:为什么健康状态像"势能井"中的小球?
因为所有这些都是同一套调控机制的不同切面,而这套机制决定了你的生理状态。DNA甲基化的变化会影响转录水平,进而影响代谢物、脂质和蛋白质的水平。这些变化又会影响新陈代谢,而代谢变化会反映在临床参数中,这些参数我们在临床上已经常规测量。最终,所有这些变化都会在生理特征和身体功能上显现出来。
因此,只要数据质量高且数量充足,从任何这些特征空间中提取衰老特征信号实际上都是可行的。那么在这种情况下,我们应该怎么做呢?我们如何从中提取这些衰老特征信号呢?
在这点上,我想请大家原谅,让我释放一下内心的物理学家天性,使用物理学家面对复杂系统或问题时常用的技巧。我们通常会选择在低于四个维度或无限多维度的条件下讨论问题,因为这基本上是我们唯一知道如何处理的方式。接下来我要给大家展示一个二维的例子,这个例子很能说明问题,但当然不能作为证据,它只是用来展示我认为我们应该寻找的那类事物。所以,假设我们有生理学和特征空间。
这样就有了一个二维空间,可以用来追踪任何类型的生理参数。这可能是低密度脂蛋白胆固醇和血压这样简单的指标组合。或者可以是分解代谢和全身性炎症,又或者是两个不同类型的参数,比如某种基因表达模式、转录组的主成分分析等,无论你想使用什么参数都可以。
无论选择什么参数,你总会有一个代表健康年轻人的生理状态点,这就是你理想上应该处于的位置。在这个位置周围存在一片区域,这基本上是正常生理功能发挥的区域。日常环境中的随机波动会使你在这个区域内来回移动,但这些变化都仍然属于正常健康的生理状态范围。
然后,在特征空间中会有一些区域,可以称为疾病或衰竭吸引子。换句话说,如果你被推入这个区域,这就意味着你可能出现健康问题、功能衰竭或其他负面结果。而你的基因调控网络的任务,就是我刚才通过那些特征空间切片展示的,本质上是防止你进入这些区域。
物理学家喜欢大道至简,所以二维空间非常理想。同样,简单的弹簧振子模型也很受欢迎,因为这也是我们擅长处理的类型。
所以本质上,你可以想象这整个复杂的基因调控网络的目的是,当你面临干扰时,将你引导回生理正常状态。当然,我们可以用某种回归势能来替代前面比喻中的"弹簧",这种三维势能场的核心作用就是尝试将你拉回正常生理状态。而我们前面提到的“衰竭吸引子”,其实只是用另一种方式描述相同的概念。
于是你最终会得到这样一幅图景:你就像图中的那个小红球,处于正常的生理状态。当你受到微小干扰时,你会在这个碗里来回弹跳。这就是我们日常生活中的各种波动。比如说,你可能刚经历了一次长途飞行,或者前一晚喝了太多啤酒,这会导致你的身体状态暂时有些失调。然后经过休息,你的状态就会恢复正常。
这里描述的人就像"金刚狼"那样的角色,基本上无论受到什么干扰,都能迅速恢复正常状态,这正是年轻人的特点。所以如果你把很多人放在这个模型中,比如这个例子中的25人,他们的表现都非常类似,在正常健康的生理吸引子周围弹来弹去,不会出现任何令人惊讶的情况。
但回到我之前讲过的另一个关于测量氧化损伤的故事,其中一个奇妙的...不,不对,应该说是其中一个谜团在于:我们观察到氧化损伤只呈现小幅度的线性增长,这种增长与生存率之间从未被证实存在强烈的因果关系。那么问题来了,在这种情况下,我们如何解释这种现象:线粒体中的氧化DNA损伤仅仅是线性小幅增加,而死亡风险却呈现出指数级的增长?
答案其实很明显:任何未被完全清除的损伤或进入系统的熵增,都会使系统运作效率略微下降。这是个很直观的推论,如果某物受损,它的功能性必然会比之前差一些。所以在这个模型中,随着损伤积累和未完全修复的熵的积累,你的基因调控网络功能逐渐减弱,最终导致势能场变得更加平坦,将系统拉回正常状态的恢复力也随之减弱。
这实际上是一种很精妙的思考方式。如果你现在把25个个体放在这个模型中,他们仍会在势能场中来回弹跳,但偶尔会有个体克服势垒,从这个平面掉出去。事实上,这个模型在多方面都很精妙。首先,势能是线性下降的——红色势能最低,蓝色势垒最高,但这个势垒随时间线性减小,所以整体呈现线性下降。
但这也导致了势能高度的逐步降低。如果从理论物理学家的角度,你会说特征值符号发生了变化。在老年医学中,你会说内在能力降低了。在老年学中,你可能会说恢复力降低或稳态空间缩小,但这都是线性变化,对吧?如果你直接测量这些参数,你会发现势能高度确实是线性降低的。但当你进行计算(这在物理学中是个经典问题),或运行一个小型模拟,你会发现失败概率呈指数级增加。换句话说,恢复势能高度的线性变化会直接导致死亡风险的指数级上升,非常符合预期,这是这个模型的精妙之处。
这个模型还会呈现另一个现象,如果你在其中绘制不同年龄段人群的分布情况,你会观察到在特征空间中的移动趋势。由于势能场变得更平坦,人群会更逐渐向"衰竭吸引子"靠近。因此,你会观察到两种效应:
首先,人群的中位点或个体轨迹的中位点发生变化,具体表现为从蓝色到绿色,再到橙色,最后到红色的位置变化;其次,你会发现方差显著增加,这意味着年长个体之间的差异比年轻个体更为明显,他们在特征空间中的位置也各不相同。
到这一步,你已经拥有了可以探索并用来构建生物年龄时钟的素材,因为你能够观察并识别这些特定的模式。而降低维度并找出这类模式的最简单方法之一,就是使用主成分分析。相信大家在观察基因表达模式时都已经接触过它。在处理其他类型的数据时,你也会使用二维主成分分析这样的方法来展示结果。
但从本质上讲,这种技术的原理是识别出那些具有协变性或相关性的特征,然后沿着最大协方差的轴旋转坐标系。这就是一个线性变换过程,它只是旋转了你的坐标。这样一来,我们就得到了一个新的坐标系,其中现在的x轴,也就是第一主成分,携带了大部分的协方差信息。这其实就是矩阵分解,你的数据矩阵可以被分解为若干个主导的主成分。这就是降维,用显著更少的坐标轴,就能保留原始数据中的绝大部分信息。
因此,如果你用我刚才展示的那个小图例来应用这种分析,就是那个展示人群在特征空间平面上处于不同位置的图,你基本上可以在三维空间中直观地看到这种变化。这会直指衰竭吸引子。这当然是必然的,因为你的人群正是沿着这个方向移动的。
这里的直觉其实就是:当你分析任何类型的高维数据集,其中包含不同年龄的个体,这些个体在患各种疾病和死亡风险上存在差异,那么主导的主成分必然会指向"衰竭轴"的方向。你可以利用这些主成分来构建时钟,这些时钟的维度远低于原始特征空间,这一点非常重要,因为许多特征空间确实庞大复杂。
15:51📍 彼得·费迪切夫的断言:第一主成分永远是衰老
如果你与机器学习领域的人交流,他们通常认为这类技术要求样本数量基本上要多于特征数量,或者至少在同一数量级。然而你知道,某些数据集轻易就有上万甚至十几万个特征,但要收集同等规模的个体样本却极为困难,尤其是那些带有死亡率数据的个体。要获取10万人随时间变化的纵向数据几乎是不可能的任务。
因此,这种降维的方法非常巧妙,它能以一种可预期的方式专门提取与衰老相关的特征。此处不得不引用我的朋友彼得·费迪切夫所言,他几年前在我办公室里随口说的一句话:从衰老队列中得到的高维数据集的第一主成分,永远代表的就是衰老过程。
我花了一段时间才真正相信这个观点——这正是我现在重点探讨它的原因。但正是这个发现促使我开始系统性地思考如何有效提取衰老特征。这里有个例子可以证明这一现象并非仅限于二维简化模型。这是我们实验室采用的另一种无脊椎模式生物,果蝇。这张图展示的是转录组的主成分分析,涵盖了数千个基因。实际上,第一个主成分反映的不是衰老,而是性别。
因为在数据集中,最大的协方差来源是雄性和雌性果蝇之间的差异。但除此之外,你能清晰看到不同日龄的分布,比如第5天、第20天、第30天、第40天和第50天。果蝇的衰老轴非常明显,而且这种衰老模式在雄性和雌性果蝇中保持一致。
因此,你可以利用这点构建只有一个维度的时钟。只需直接用这个图表中的y轴,就能较为准确地推断出果蝇的年龄。这实现了惊人的降维过程,从原本成千上万个特征,简化到仅需一个特征。当然,你也可以在更多特征的基础上继续构建更复杂、更精确的时钟模型。
这个直觉引导我们说:好,那我们就试试看吧。我们已经在简化模型上验证过,也在线虫的脂质组学数据和果蝇的转录组学数据上进行了测试,还在模拟环境中做了尝试。于是我们想:不如做些更直接实用的研究,选择一个可以立即应用的特征空间——那些日常生物标志物,比如胆固醇、血压、吸烟状态、身高、体重等常规指标。
18:08📍 从163个血液指标到18个核心维度:构建实用"死亡时钟"的降维奇迹
我们利用一个增强数据集,提取了这些信息,包括人口统计数据、问卷调查数据(如"你现在感觉如何"、"去年感觉如何")、医学检查数据和临床实验室数据。这样就获得了年龄、性别、吸烟情况、BMI、血压、低密度脂蛋白等共计163个参数。这个数据集包含数千名受试者。
但直接对163个参数进行回归建模会产生大量拟合噪声。理想情况下,样本数应该远多于参数数,但实际操作中很难实现。因此,我们采用了主成分分析。有趣的是,某些主成分确实表现出与我刚才展示的简化模型完全一致的特性,它们与年龄明显相关,并且随年龄增长方差也增大。当然,并非所有主成分都这样,但部分主成分确实呈现这种模式。
比如在这个例子中,这些主成分主要反映了骨密度和身体成分的标记物。随着人们年龄增长,个体间的差异变得更大,同时这些参数也随年龄系统性地发生变化。
所以这其实在生物学上并不让人意外,但它却非常容易被一个我甚至不好意思称为“人工智能”的模型学会。说到底,这其实就是线性代数加上一些统计方法,虽然从技术上讲确实算是机器学习。顺便说一句,这项工作现在已经被《Nature Aging》接收了,如果你感兴趣,下个月就能看到发表的文章。
从生物学角度看,这个结果并不令人意外,但令人惊讶的是,它能被一个我甚至不好意思称为"人工智能"的模型如此轻松地学习到。实际上,这只是线性代数加上一些统计方法而已,虽然从技术上讲,确实可以归类为机器学习。顺便一提,这项研究已经被 Nature Aging 收录,如果你感兴趣,下个月就能看到正式发表的文章。
总之,我们将问题转化为一个包含3,000名受试者和18个变量的回归分析,这个规模已经非常易于处理。随后,我们采用了最简单的方法来训练模型预测未来死亡风险——具体来说,就是应用Cox比例风险模型来预测接下来20年的生存情况。
这种方法相当直接:本质上你会发现这些主成分(PCA)与一个线性的"年龄偏差"相关联。之所以这样做,是因为这是验证预测能力最简单的方式。得到的结果并不令人惊讶,因为从构造上看,它本来就像一个生物年龄时钟,X轴是实际年龄,Y轴是生物学年龄。你会看到有些人,他们的生物学年龄远高于实际年龄,这些是我们用“时钟”预测出来的“死亡年龄”较高的人,两者是相符的。这些人在戈姆佩茨模型下的死亡概率明显高于其实际年龄所预测的水平,而另一些人则要低得多。
那么问题来了,这个模型真的能预测吗?它真的有用吗?它真的有效吗?
我在这里以70岁年龄段为例,也就是65到75岁的人群。我们将这组人按生物学年龄分为前25%和后25%两组。对于被时钟判定为生物学年龄最高的那组人,也就是死亡风险远高于实际年龄暗示的人群,确实只有约20%能存活20年,这意味着他们很难活到90岁。相比之下,被判定为生物学年龄最低的那组人中,超过75%能活到90多岁。因此,这个模型对未来生存状况的预测能力相当强,这也正是模型训练的目标。
此外,你还可以进一步分析,因为主成分分析和非线性降维技术相比,还有个很大的优势,就是它的结果非常易于解释,你可以很直观地理解这些主成分。
我们又对特征空间做了聚类分析,将十八维的数据降到二维来展示,然后识别平面上各点的人口统计特征。结果显示,绿色聚类代表健康老龄化的人群,这些人拥有最长的预期寿命。你可以看到健康老龄化群体的生存曲线位于参考群体之上。相比之下,其他点则分散各处,并不形成明确的聚类。
21:52📍 托尔斯泰名言的启发:健康的人都一样健康,不健康的人各有各的问题
这让我们想到托尔斯泰的名言:幸福的家庭都是相似的,不幸的家庭各有各的不幸。同样,患病的人各有不同,他们以各种各样的方式生病,而健康的人则以相似的方式健康。至少在这种主成分展示中是这样,这也正是我们所预期的。
有趣的是,数据中清晰呈现出一个代谢-心血管轴。当我们增加聚类数量,比如设置为六个或七个簇时,基本上是对原本的紫色和橙色簇进行更细致的划分。这表明人群在代谢性疾病方面存在不同程度的影响,这显然是系统捕捉到的一个关键特征。具体来看,紫色簇中的人群呈现轻度代谢异常,而到了橙色簇,其代谢问题则显著恶化。那么,红色簇又代表什么类型的健康"失效"呢?
但有意思的是,数据中还存在一个黄色簇,我们称之为"多病共存且虚弱"的人群。这些人并不肥胖,没有超重问题,更没有代谢疾病,但他们的寿命同样很短。也就是说,橙色簇和黄色簇的生存曲线几乎一致,尽管他们在身体组成方面几乎完全相反。那么问题来了,他们到底有什么共同点?如果一组人超重而另一组不是,但两组的生存结果却相同,那么他们之间一定存在某种共性。实际上,这种共性体现在一个特定的主成分上。
所以问题变成了:是什么让一个人从健康的绿色簇转向橙色簇或黄色簇?顺便说一下,图中紫色的点代表数据集中的百岁老人,数量非常少。那么,从绿色到橙色,以及从绿色到黄色,共同的驱动因素是什么?答案就是,一个特定的主成分:第四主成分。在这两组人之间,第四主成分的数值差异非常显著。
由于主成分分析是线性的方法,你可以直接观测到特征,可以问自己:到底哪些生物学特征在驱动这种变化?有趣的是,当你绘制这些特征的相关性图,观察它们在整个数据集中的相关模式,并提取第四主成分值处于最高和最低百分位的人群时,会发现一些深层次的规律。
从这项分析中可以看出,第四主成分富集了多种炎症标志物,包括纤维蛋白原、C反应蛋白、球蛋白,同时也包含了器官衰竭和代谢紊乱的指标,例如血糖调控异常等。
有趣的是,本质上这是一条在超重人群和多病共存人群中都呈现的炎症轴。两组人群的共同点是系统性炎症水平升高,这同样也与你能推测的情况相符。值得注意的是,这个线性分类器能够相当快速而简便地识别出这一规律。
24:23📍 所以吃药达到"最佳状态"的人比天然健康的人活得更久?
那么,这就引出了一个问题:我们能用这些发现做什么?我们进行了一系列探索,如果你查看海报,你会发现我们收集了一些血管紧张素转换酶抑制剂的数据。我们想知道哪些药物可能影响这个主成分。具体来说,我们能否观察到复合药物的效果,尤其是那些影响已知年龄相关疾病风险标志物的药物,比如降血压药物、他汀类药物等等。这就是我们目前所做工作的总结,研究仍在持续进行中。
我们首先提出一个问题:是否可以建立一个"健康最优性评分"。我们分析了人群中有多少比例的人没有任何异常指标,即血压、胆固醇以及所有其他生物标志物都处于完美状态。数据显示,在20岁年龄段,这一比例高达80%以上;而到了80岁,这一比例仅剩约60%。这些数据来自未接受药物干预的人群。由于我们拥有详尽的药物使用记录,我们可以确认这些是不服用任何药物、自然状态下保持健康的人群。
从另一个角度看,如果我们关注那些按照现行医疗标准明显需要干预但实际上没有获得治疗的人群,换句话说,那些被医疗系统遗漏的人,实际上这个比例在美国国家健康与营养调查中超过了20%。换言之,有超过20%的人存在某种健康问题,任何全科医生都会认为这些问题需要采取措施加以解决,但实际上这些干预并未发生。
你可能会再问,这些重要吗。当你观察70岁左右的人群,可以明显看到在10年随访期间,他们的生存率存在显著差异。健康状况最佳的人群生存率最高,其次是那些处于临界状态的人群,而那些明显需要治疗的人群生存率明显较低,正是基于这一点我们制定了治疗指南。这表明,如果一个人的健康状况不理想,这本身就是一个风险因素,这里我们分析的都是不服用任何药物的人群。
我们来看看这个情况,来看看这个问题。是的,这就是第四主成分的情况,结果与预期一致,处于临界状态的人群的第四主成分明显更高,表明他们体内的炎症水平比健康状况最佳的人群要高得多。这正好印证了假设:更高的炎症水平与更低的生存率相关。
但问题是,如果我们现在引入另一组人,他们的健康指标达到最佳水平,但这完全归功于他们在服用药物,会呈现怎样的结果呢?这些人在各项参数上都表现良好,但他们是通过服用他汀类药物、降压药物或血管紧张素转换酶抑制剂才达到这一状态的。换言之,他们的良好健康状况完全依赖于药物干预。
如果你观察这些人的第四主成分,你会发现数据分布很广,甚至他们的数值比那些自然健康的人还要低。这是否意味着在这一炎症标志物上,药物干预组表现更好?从严格的统计学角度看,这一差异并不显著,但数据确实呈现出更低的趋势。可以肯定的是,他们在这一指标上,至少与那些不需要药物干预就能保持健康的人相当。
有趣的是,如果你进一步观察生存率,并将"健康状况最佳"这一类别细分为"不服药人群"和"服用复合药物人群",数据显示在这个分类中,实际上是服用复合药物的人群生存得更好。换句话说,通过药物来良好控制健康状况,相比于仅仅依靠生活习惯或者良好基因这种自然过程来维持健康,似乎更有益处。
现在,我们仍在考虑这可能存在的偏差:那些服用药物并达到最佳健康状态的人可能只是更加注重自我保健,并且能够获取更多医疗资源,或者还有其他因素,比如这些药物可能具有一些预期之外的益处。例如,某些干预措施可能普遍降低体内炎症水平,我们正在逐一研究这些可能性。
27:57📍 颠覆临床实践:从"多运动,半年后再看"到主动的最优化医疗
不过,我们从生物年龄时钟研究中已经得到,并且我们认为确实成立的一个关键信息是:早期和积极主动的干预至关重要,保持最佳健康状态同样非常重要。我认为这是一个巨大的问题,因为如果你去看全科医生,告诉医生在你这个年龄段,某些指标已经处于临界状态,你几乎必然会得到这样的建议:好吧,试着做得更好一点,去进行一些运动,我们六个月或者一年后再见。
就我个人而言,我并非在提供医疗建议,因为我不是医生,但至少对于我自己和我的家人,我从这些研究中得出的认识是:保持在最佳健康参数范围内可能比完全不依赖药物更为重要,而且我已经基于这一观点做出了相应的选择。好的,让我简要总结一下结论。
我认为死亡时钟之所以有价值,是因为它们提供了一个客观的比较标准。假设存在两个时钟模型,能更准确地预测死亡风险、生存率或生死结果的模型无疑更优,这一评判毋庸置疑。不过我们目前的模型仍然是线性的,无法形成U型响应曲线。这显然是当前的局限性,我们需要引入非线性技术来改进,但这类方法的解释难度更大。由于它是一个线性模型,它仍然将疾病和年龄的内在影响混合在一起。它展示的是与疾病吸引子之间的距离,而这些吸引子与年龄有着强烈的相关性。使用这种技术,我们无法轻易地将这两种影响因素分离开来。不过,也确实存在其他方法。
另一个结论毫不意外,没有人能在进入老年后依然保持最佳状态,说“没有人”可能夸张了,应该说是“很少人”。最后一个结论是,尽早进行积极主动的干预!
最后感谢给予过我重要支持的人,Brian,以及我很有幸与冯医生共事,他是一位非常出色的老年病专家,与我一起合作研究这个时钟。
还有 Peter,和他讨论这些想法特别有意思;还有kirill,是Gero公司的AI从业者,目前在我的实验室实习。非常感谢大家。我看到计时器上已经开始闪零了,所以我想我得结束了。
我想我们可以通融一下,让观众提几个问题,尽管时间已经到了。 关于刚才的内容,大家有什么问题吗?
好的,谢谢。相比于处于最佳状态的个体,那些服用多种药物的人群的均值周围存在相当宽泛的置信区间。我很好奇,对这些个体实际服用的药物进行了多深入的研究?例如,已有研究表明,服用二甲双胍的糖尿病患者往往比不服用二甲双胍的非糖尿病患者寿命更长。但二甲双胍可能只是一种具有这种特殊效果的药物,其他药物可能会产生相反的影响。所以我想知道,您或者其他研究者是否调查过这些服用多种药物的个体的用药方案构成?
是的,论文中的原始例子是血管紧张素转换酶抑制剂。我们首先研究了这个例子,它算是一个相对容易分析的案例,因为它有一个非常明确、强烈且具有高度负面影响的标志物。当然,你在进行标准化处理时,也需要首先对其余主成分进行标准化。这是最初的研究案例,也就是你刚才提到的主要形式的例子。
我们确实拥有各种单独药物的个体数据,但我们还没有完全解析这些数据。一个原因是,每当你进一步细分分析时,样本数量就会变小。因此,我们正在合并一个更大的数据集,以便对这些数字有更高的置信度。
你好,我想问的也与这个问题有关,服药数量本身是否很重要?或许可能存在一个U型曲线关系,服药过多或过少都是一个影响因素。您能否研究确认这一点?
是的,我们当然也有这些数据,并且已经整理成了表格。您是指单一复合药物、两种、三种等等的情况,对吗?我们确实发现,当药物组合数量达到很高时,益处会消失。再次说明,要精确区分1到5种药物的效果很困难,因为大多数患者主要使用一种药物,其次是两种。而当患者使用三种、四种或五种药物并将它们归类时,这最终会产生负面效应,因为它表明这个人可能存在多种问题。不过,这些内容尚未收录在论文中,还属于非常早期的数据。我只是觉得这非常有趣。
我在思考你提到的第一主成分总是代表衰老这一说法。我在想这是否也与数据本身有关。当然,如果你的样本是非常年轻的动物,你观察到的变化可能是呈指数型的。所以,如果你尝试将数据按年龄分组,使其逐渐偏向更老的个体,那么最第一主成分是否会越来越明显地代表衰老,或者会有其他变化?
我实际上认为这些变化并不是指数型的,这正是其中一个有趣之处。我们所观察到的是,很多年前当我还在研究自由基时,有一个恶性循环理论,当你受到的损伤越来越多,更多的损伤会导致更多的氧化,就像生锈一样,而氧化又导致更多的损伤,结果损伤呈指数增长,死亡率也随之呈指数上升。
你知道,我花了将近十年的时间试图去证明这个理论,换了多种方法去测量,但这种情况从未发生过。现在这里的情况也是一样。这里没有任何特征是呈指数增长的,部分原因是大多数指数变化可能与生存不相容。也许是C反应蛋白之类的指标。有些标志物在出问题时确实表现出很强的效应,你可以说这类情况符合指数变化,但总体来说,变化主要是线性的。
但你说得完全正确。如果你观察发育中的动物,第一主成分肯定会是发育。如果你观察儿童,那就是生长和发育,而不是衰老,尽管它与时间相关。但如果你混合男性和女性的数据,那么第一特征就是性别。如果你的数据中疾病较多,比如你有一个包含健康人和癌症患者的队列,那么第一主成分很可能就是癌症状态。但如果你研究从成年到老年的整个生命历程,那么它就会是衰老。我还没有在生命的不同阶段子集中分析过,我可以尝试一下。
你和费迪切夫一起做出了非常了不起的工作,我们也看到很多像摩根·莱文以及其他团队那样酷炫的生物年龄时钟研究。我特别好奇的一点是,你提到过需要更多样本来训练更好的时钟,可能还包括非线性时钟,以及更好的因变量,比如死亡率和当前年龄等等。但你是否见过一些有说服力的例子,比如功效模拟,能够确切地告诉我们需要多少样本,比如比生物样本库还要多10万个样本的规模,具体需要多少样本才能把误差控制在一年以内?
我觉得这里的关键词是"有说服力"。你知道,我其实可以很容易地用我手头的模型跑一些模拟。但问题是,这样做的前提是你要假设系统是一个带有一定大小随机噪声的谐波回归势场。如果是这样,那你当然可以得出一个答案。但是,人类比这种假设要复杂得多,对吧?所以,哪怕只是想准确地捕捉到方差的增长,其实也很困难,因为实际的人类数据中还有太多其他来源的变异。所以我的答案是,我不知道。我没见过特别有说服力的结果,但说实话,我自己也不知道怎么做,做出来我自己可能都会觉得像是在骗人。好的,谢谢大家。
——
延伸阅读
- LinAge2: providing actionable insights and benchmarking mortality prediction
- Principal component-based clinical aging clocks identify signatures of healthy aging and targets for clinical intervention
——
No comment
00:00
/ 35:34