
E04 如果进化能创造永生基因,为什么却选择了衰老 ♾️ Peter Lidsky: 寻找衰老的统一理论范式 | 他山之石



欢迎收听不朽真龙博客,我们是一家投资长生不老领域的使命驱动基金,投资之外,我们出版翻译书籍、资助行业会议和学术机构,制作播客和媒体内容,从而支持抗衰科学研究,布道续命理念信仰。
你现在收听的是他山之石系列节目,我们通过翻译与 AI 语音克隆,让全世界的科学家和思想者用中文为你讲述最前沿的longevity技术与理念。本系列由不朽真龙团队制作,内容已获授权,对其中学术观点保持中立。
本期他山之石的嘉宾是 Peter Lesky,他颠覆性地提出了衰老的病原体控制假说,认为衰老并非随机损伤的累积,而是进化出来的精密程序。如果这个理论成立,那么我们对衰老的整个认知框架都需要重新构建。接下来的演讲,它将用令人意想不到的角度回答一个最基本却最困难的问题,我们究竟为什么会衰老?
01:13📍 延长健康寿命,而非延长寿命:保持尊严体面的健康直到死前的最后一秒
感谢大家到来。今天我想探讨一个问题:我们为什么会衰老,以及我们在寻找衰老范式方面的进展。
首先,衰老是许多疾病的核心风险因素,即所谓的“年龄相关疾病”。可以看到,心血管疾病、阿尔茨海默症和癌症的发病率都随年龄增长而上升。按理说,衰老本应成为公共卫生的重点。
然而,从资金投入来看,情况并不乐观。美国国家衰老研究所的预算只占总预算的9%。而且如果我们仔细看这些资金的去向,会发现真正用于基础衰老研究的比例微乎其微,大部分都投入到了阿尔茨海默症研究。这是为什么呢?
此外,Jay Olshansky最近发表了一篇论文,他指出:我们延长人类寿命的机会已经基本耗尽。过去一个世纪里,人类的预期寿命不断上升,但现在似乎已经进入了平台期。如果我们还想进一步延长寿命,就必须在医学科学方面取得突破。
Eric Verdin 是衰老研究领域的关键人物之一,他对上述观点做出了回应。他表示,这项研究应该促使我们冷静下来,降低对延长寿命的期望。他认为我们应该把重点放在眼前真正的任务上:延长健康寿命。
什么是健康寿命?相比于寿命,我们更要关注健康寿命。大型慈善组织Hevolution的负责人Mahmood Khan也表达了同样的观点,他说:"我父亲常说,'我想自己走着去坟墓。'"意思是保持健康直到生命终点,然后迅速而体面地离世。
但现在看来,我们似乎并没有在关注根本原因,而是在分别应对这些呈指数增长的疾病曲线。这里只显示了四种疾病,实际上还有关节炎和肾脏疾病等。
这其实是一个相当奇怪的思路,就像有人建议治疗新冠时,不去研究病毒本身,而是分别解决咳嗽、发烧和头痛一样。这种做法显然是行不通的。
03:24📍 损伤累积还是程序化过程?这个岔路口决定了99%的研究努力会否白费
那么,为什么许多受过高等教育的聪明人会建议我们将研究重点从延长寿命转向延长健康寿命呢?
因为,令人意外的是,我们并不知道“衰老”究竟是什么。
这是 Vadim Gladyshev 带领的大型团队上个月发表的论文。他们对该领域专家进行了调查,结论是对于"什么是衰老"这个最基本的问题,每个人的答案都不同。他们制作了词云图,这个领域最重要的未解之谜就是:什么是衰老?大家在这点上达成一致。
所以我们现在还没有一个清晰的定义,也没有一个统一的理论范式。而这正是限制我们应对衰老问题的关键瓶颈。
为什么寻找衰老范式如此重要?比如,有了范式后我们首先要问的问题是:衰老到底是一个“熵增的损伤累积过程”,还是一种“程序化的基因过程”?
如果是第一种情况,我们需要帮助这些"点"回到原来的位置。如果是第二种情况,我们需要找到那把"枪"并取出子弹。这是两个完全不同的项目。
第一种情况下,我们是在修复某些东西;第二种情况下,我们是在拆解某种机制。如果我们在这个关键岔路口选错了方向,99%的努力可能都会白费。大多数研究者选择了营养模型的方向,即损伤累积假说,而我认为这条路是错误的。
我们面临的另一个关键问题是:人体是否真的可能实现逆转衰老?
去年我们在Foresight研究所举办了一场辩论,我看到Allison笑了,那确实是势均力敌的一场辩论。两位专家争论的核心是:是否可能让人逆转衰老?这是一个非常重要且实际的问题,因为在一种情况下,我们需要用老年小鼠做实验,尝试让它们逆转衰老;在另一种情况下,我们需要用中年小鼠,试图让它们的衰老过程停滞。但到目前为止,我们仍然没有明确答案。
从形式上看,认为不可能逆转衰老的一方获胜了,但实际上是平局。评审团的投票非常接近。我觉得几年后如果再举行一次辩论,结果可能不会重演。我正在尝试回答这个关键问题:什么是衰老?我的策略是:先从那些相对容易的问题入手。
第一个相对容易的问题是:为什么不同动物的衰老速度差异如此之大?
以老鼠为例,它的寿命大约是2年,最多4年。而松鼠,体型相近、饮食习性也相似,却能活20年。这些非常相似、亲缘关系很近的动物,只是尾巴大小稍有不同,为什么寿命会有如此巨大的差异?
传统观点认为,不同动物的损伤控制效率,是根据其所处的特定生态位来调节的。影响这些生态位参数的因素包括:外源性死亡率、成熟时间、代谢率等,这些因素看起来都简单易懂,甚至有点无聊。
但这种解释并不正确如果你观察那些能活得更久的小型动物,这些动物的体型都与老鼠相仿,你会发现,布氏鼠耳蝠能活40年,麻雀能活20年,青蛙能活25年。
这些动物成熟得很快,代谢率很高,其中一些还面临很高的外源性死亡率。它们显然是例外情况。所以老年学家通常列出的那些因素,明显存在无法解释的例外。而松鼠和老鼠的寿命差异只是这个寿命梯度的一部分。
还有一种裸鼹鼠,它们几乎不会衰老。如果你看这张图,会发现它们的死亡率并不随年龄增长而上升,但我们仍然无法解释为什么会这样。
在这个梯度的另一端,我们看到了北方袋鼬。这是一种生活在澳大利亚的有袋类动物,它们在首次繁殖之后很快就会死亡,这叫做单次繁殖。类似的现象也可以在太平洋鲑鱼中看到,它们逆流而上产卵,然后以一种非常奇特的方式死亡。这些北方袋鼬也会经历一次剧烈的荷尔蒙激增,这是导致它们死亡的机制性原因。
07:51📍 经典进化理论为何无法解释野外动物真实的衰老现象?
令人惊讶的是,这种单次繁殖策略在有袋食肉动物的进化树上多次独立演化出现,但在啮齿动物、食虫动物中没有,在占据相似生态位的食肉动物中也从未出现过。
那到底发生了什么?为什么这种现象只出现在有袋类动物中?这个问题目前还无法解释清楚。
再看这个“彩虹般的寿命梯度”,请问在这套模型中,损伤在哪里?熵增又在哪里?确实,如果你观察衰老的身体,我们能看到损伤,但在其他任何疾病中我们也能看到损伤。比如在新冠中,我们同样能观察到许多损伤。有人提议通过分类所有损伤并逐一处理来治疗新冠吗?我认为这不是合理的方向。所以我用进化论来概念化和合理解释这些观察现象。这是生物学中使用的经典方法。
正如名言所说:“脱离进化理论,生物学毫无意义。”现在我来简单回顾一下,现代关于衰老的进化理论。有两位学者提出了一个叫做“选择阴影”的概念。他们的观点是:动物往往死于捕食、饥饿、寒冷等外部因素,这些因素与衰老无关。
因此在自然状态下,绝大多数个体在到达某个年龄之前就已经死亡了,所以 自然选择根本“看不到”更高年龄阶段的个体,也就不会“关心”它们发生了什么,这使得衰老在进化上变成了“中性”特征。换句话说:一个动物在 100% 会死的前提下,它的身体在死亡之前会发生什么,进化根本不关心。但问题是,这个模型预测动物在野外不应出现衰老现象,然而事实并非如此。
比如我们看狮子的死亡率,我们会立刻发现,5 岁狮子的死亡概率远低于 14 岁的狮子,而且狮子在野外的确能活到 14 岁。这就意味着,如果出现一个突变的狮子个体,它的死亡曲线更加平缓、寿命更长、能留下更多后代,这个变体将被进化所选择。但为什么这种情况没有发生,这个模型无法解释。于是,有人试图为这一现象做出解释,那就是 G.C Williams,他提出了著名的“拮抗性多效性假说”。
他假设存在这样一类基因:它们在个体年轻时是有益的,但在年老时是有害的。如果这种基因真的存在,那么它们能帮助大部分仍然存活的动物,但只伤害少数能活到一定年龄的动物。如果我们相信这样的基因存在,那么确实可以用它来解释衰老。但这个假说的问题是,至今没有人找到过一个真正的拮抗性多效基因。确实存在一些基因,它们具有两种功能,一种有益,一种有害。然而,仅凭这一点还不足以解释衰老。
因为要使这个理论成立,这两种功能必须在进化上稳定关联,而这种关联的进化稳定性从未被证明过。即使我试图从理论上想象,也不可能。我想不出一个例子。学术界提出的所有例子显然都站不住脚。我能清楚地看到进化如何能够切断这种联系。
理论发展的下一个阶段由 T. Kirkwood 推动,他提出了“一次性躯体理论”。他认为,寿命与繁殖之间存在根本性的权衡关系, 而能量是调节这种权衡的主要货币。
我们一生中能够获取的食物是有限的,所以我们可以选择将它的能量用于繁殖,或者用于身体的修复。如果我们过度投入到繁殖中,以牺牲身体修复为代价,我们就会产下大量的后代。而这些快速繁殖者,正如图中所示,能够在数量上压倒缓慢繁殖者。
然而,这个模型有数学上的问题,我现在不展开讨论。但它也有更容易解释的生物学问题。例如,如果我们给动物足够的能量用于繁殖和修复,它们往往会变胖,寿命变短,而不会活得更久。再比如:雄性比雌性衰老得更快,但雄性在繁殖上的投入远小于雌性。还有,随着年龄增长,动物的食物摄入量是下降的,但按照这个模型的预测反而应该增加。再看自然生态, 一些资源贫瘠的生态系统,比如北极洞穴、深海区域,反而富含大量长寿的物种,这看起来更像是一种“节约资源”的生存策略,而不是“过度繁殖”。现在很多人使用的各种“熵增模型”和“营养代谢模型”,归根结底,它们的理论血统都可以追溯到这两个非常值得质疑的模型。是的,这些模型在解释自然界物种间的差异时表现得特别糟糕。
比如:果蝇这样的小型生物,它们的寿命却很长;在群居昆虫中,寿命差异更是巨大,白蚁女王的寿命可以是工蚁的 50 倍,但它们拥有完全相同的基因组。为什么会这样?没有明确的解释。再比如,裸鼹鼠几乎不衰老,为什么会这样?也无法解释。这两个相似物种的寿命差异巨大,原因不明。经典模型都无法解释。而且,传统模型完全排除了“逆转衰老”的可能性,因为它们一开始就设定:衰老是有害的,是无益的。
13:32📍 细菌的"自杀式防御"能否解释人类衰老的进化起源?
可如果我们承认“衰老有害”,那么逆转衰老如果可能的话,进化应该至少在某些情况下发明它。比如:当一只年老动物突然获得大量食物或者处于非常有利的生存环境时,它应该通过逆转衰老,这在传统模型看来,应当是有进化优势的行为。然而我们在自然界中并没有观察到“重返青春”的现象,也许逆转衰老在机制上是不可行的, 因为进化没能发明出这项能力。所以,我们是否能通过生物技术实现逆转衰老,这个问题是值得怀疑的。
不过,好消息是,我本人并不相信那些传统模型。因此,我们提出了程序性衰老的想法,以及两个关键问题:为什么衰老不能是程序化的?第一个问题是:这个“程序”到底有什么用?生命的意义就是繁殖。如果我杀死自己,就无法繁殖。这显然是负面的。第二个问题是:为什么我们从未见过“永生突变体”?如果我们用诱变剂处理果蝇或线虫,我们会得到没有眼睛、没有翅膀的果蝇,但从没得到过不会死亡的。所以,如果衰老是由程序控制的,那它就应该写在我们的基因中。既然在基因里,理论上我们就应该能通过突变将它破坏掉。但这从未发生过。所以衰老并不是一个“程序”。
我构建了一个模型,能够同时回应这两个关键问题。首先,我们从第一个问题入手:
如果衰老真的是程序化的,那这个程序到底是为了什么?有没有公认的“适应性死亡”的例子?答案是:有的。一个典型例子就是细菌中的“流产性感染”机制。当细菌感染上噬菌体时,它基本上已经注定会死亡,因为它无法清除这个病原体。
于是,细菌试图杀死自己,以阻止噬菌体复制和感染邻近细菌的感染,这些邻居可能是它的亲属。这些可能是它的亲属。噬菌体试图抑制它,而细菌则不断进化出新的自杀方式来对抗噬菌体的抑制。这些机制在研究中已经有非常清晰的描述。那么类似的事情在我们人类中是否也可能存在呢?
是的,原则上是可能的。如果我们有寄生虫和宿主的关系,这里以鱼类和它的寄生虫为例,假设这种鱼无法清除体内的寄生虫。那么,被感染的概率就会随着年龄增长而增加。你可以看到,八岁的鱼几乎百分之百会被感染。
现在想象一下,这种寄生虫并不会导致鱼类不育,但是假设寄生虫确实会导致鱼类不育,使它无法繁殖。那么到了一定年龄后,所有鱼都将无法产生后代,零成本,对于进化来说也是零价值。但是,这些鱼仍然可以感染它们在附近游动的亲属。在这种情况下,这些鱼就具有负面价值。它们对自己的基因是有害的,对吧?因此从进化的角度来看,仅仅基于年龄就杀死所有这些鱼是有意义的,作为预防措施。在这个模型中,关键参数是在互动网络中的亲缘关系,因为个体可能会感染它们的亲属。为此,我们开发了这个模型,并在一段时间前发表。
这是一个关于在地表爬行的领地性动物的模型。这在某种程度上复现了自然界中的真实情况,就像用GPS追踪明尼苏达州的野生狼群一样。这个想法关注的是种群结构的稀疏性。它可以在个体间的互动中保持亲缘关系,并确保病原体能够在兄弟之间传播。在这个模型中,我们模拟了疫情的传播。如果我们在短寿命个体中模拟慢性致不育疾病的流行,我们会发现疫情并不那么严重;但如果个体是长寿命的,那么病原体就会非常“高兴”,因为这些被感染的个体会活得更久。如果我们在短寿命种群中引入一个长寿命突变体,那么在没有病原体的情况下,它当然会占据整个种群,因为它活得更久,产生更多后代,过得非常“愉快”。
然而,如果我们将长寿突变体置于病原体环境中会发生什么?在这种情况下,病原体群落可以"包围"它们,不是杀死,而是阻止这种长寿突变体在种群中扩散。你可以看到,在长寿突变体聚集的区域,疫情更加严重,动物的不育率更高。它们会被来自邻近未感染区域的种群压力所取代。这就是我们认为衰老的生物学功能,清除那些年老且可能被感染的个体。
18:40📍 为什么我们从未见过不死突变体?进化的"安全机制"如何运作?
现在我们来探讨为什么看不到不死的突变体。
首先,我们确实能看到可以称为功能获得性突变体的加速衰老现象,但我们从未真正看到一只“长生不老”的裸鼹鼠出现在研究中。为什么?首先,这个问题本身就不对。我们确实看到了不死突变体。裸鼹鼠与松鼠有共同祖先以及相同的单倍型。所以我想,在这个分支的某个时间点,必然有一只“肉体凡胎的母体”曾产下一只“不死的幼崽”。
但这显然极其罕见,衰老似乎被进化某种程度上固定了。为什么不能解除这种固定?要回答这个问题,我们需要观察衰老未被固定的物种,这就是真社会性昆虫。真社会性昆虫中,蜂王与工蜂的衰老差异极大。它们显然存在两套程序。在这些动物中,有研究表明,当病原体感染工蜂时,可以将其生理程序切换为“长寿模式” ,因为病原体并不希望宿主死亡。
它们希望传播开来,而为此,它们需要时间。因此,从适应性角度看,在我们对抗衰老的斗争中,病原体是我们的盟友,因为它们希望宿主能够活下去。看这张图就明白了。黑线表示工蜂死亡情况,另一条显示蜂王的死亡情况,黄线是被感染的工蜂。
这个观点是:进化过程中发展出一些“安全机制”,用来防止病原体操控并关闭我们的衰老机制。而这些“安全机制”同样也能防止突变,也防止药物干预。对我们来说,这可不是什么好消息。原则上,从表型角度,当我们遇到这些安全机制时,我们可以将其解释为多效性基因的证据。所以这是第一个也是唯一一个能在程序性衰老框架下回答这两个问题的模型。这是个很大胆的主张,因为许多所谓的"衰老标志",也就是人们常引用的各种与衰老相关的现象的集合,我认为它们更像是一个目录。我们相信衰老的免疫层面是关键,更广泛地说,老年学应该成为免疫学的一部分。
这确实是个很大胆的主张。比如说我上次去参加学术会议,衰老研究还被归在生理学、代谢学版块。如果我下次再去参加,我认为它应该和感染学归为一类。当然,人们并不相信我,因为这个主张太大胆了。我们现在正在做的,我认为是这个项目中最重要的部分,验证进化理论。我的家庭医生说过:"先诊断,再治疗。"
我们正在制定生态学预测。实际上,我们的模型在口头解释方面比其他任何模型都要好。你可以阅读我们的综述,不过现在我没有时间一一讲解。所以我想告诉你们两个足够疯狂、值得一提的想法。第二个更容易获得资助,更接近药物开发。我们认为衰老细胞是抗病毒免疫的一部分。这是我们正在推进的一个既有趣又有希望获得资助的项目。
那么首先,我们该如何解释裸鼹鼠为什么寿命这么长?
它们是真社会性动物。裸鼹鼠像蜜蜂和蚂蚁一样,有蜂王和工蜂。
在这种种群结构中,根据我们的模型,
它们可以恢复细菌式的防御机制。
也就是说,如果第一只感染病原体的裸鼹鼠自杀,就像切腹自尽一样,那么整个种群就可以迅速后撤,从而清除所有病原体。
这是比衰老更高效的病原体控制方式。
那么衰老就变得多余了。
确实,有一些病例报告显示裸鼹鼠对感染极度敏感。
如果感染某些病毒,它们会立即死亡。
这种病毒,单纯疱疹病毒,是对小鼠完全没有影响的病毒。
所以这个观点是:它们进化出了真社会性,这促进了感染后的自杀反应,最终导致了它们进化出“几乎不衰老”的特性。
第二个项目中,我们试图解释,为什么单次繁殖会在这些食肉有袋动物中进化出现,而不是在其他哺乳动物中。
我们的想法是,模型预测这些动物应该具有某种独特的疾病,这种疾病在其他具有相似种群结构和生态环境的食肉动物或食虫动物中并不存在。事实上,我们知道这是什么,别无其他的可能。
你可能听说过袋獾面部肿瘤病。这是一种大约几十年前在一只雌性袋獾身上出现的传染性癌症。
这些癌细胞可以从一只动物传播到另一只动物。
这种疾病有非常独特的特征,因为它传染性极强,致死性极高,而且潜伏期很长。
根据我们的初步数据,它确实能够刺激单次繁殖的进化,因为这些动物每年繁殖一次。而感染高峰期正好出现在繁殖季节。
通常来说,雄性如果在繁殖季节感染,就没机会活到下个繁殖季,但它可以在非繁殖季四处游荡传播感染。那么从进化角度看,这种哺乳动物就没有继续存活的理由了。
虽然袋獾目前并不是单次繁殖动物,但在文献中,已经有人在“一次性体细胞理论”的背景下,讨论了袋獾对袋獾面部肿瘤病反应中单次繁殖的进化,而我们认为这种进化是被调控的。有趣的是,现在已经有两个独立的袋獾面部肿瘤病毒株在袋獾中持续存在,这说明这些哺乳动物确实对面部肿瘤非常易感。
关于这个过程,我们有一个生理模型 —— 我们也在研究流行病模型,但从生理学角度看,这些动物具有某种特定的胚胎发育方式。在胚胎发育过程中,胚胎与母体之间存在合作,同时也有炎症反应。
这种机制可能在“非自身识别”和“为胚胎提供营养”之间造成了权衡。我们的观点是,这种胚胎发育机制导致了较差的非自我识别能力,这也在一个小病例报告中发表过。那是一项很小的研究,但它也指明了我们的方向。而这最终导致了可传播肿瘤的持续、反复诱导,最终导致单次繁殖的进化。
我们有两个非常疯狂的预测,在完成理论研究之后,我们想要验证:
一是裸鼹鼠对感染的超敏感性,二是在其他有袋类动物中存在可传染的癌症。
其他食肉有袋动物中,袋獾可能是量级最大的。
这也就是为什么我们首先在它们身上观察到传染性癌症。
现在我们来说说细胞衰老,我还剩9分钟。
你们可能知道,细胞衰老是指细胞停止分裂,
但它们并不会死亡。
它们对死亡具有抵抗性,对程序性细胞死亡也具有抵抗性。
它们还会产生大量信号分子,
首先是炎症相关的信号分子,可以使其他细胞继发性地进入衰老状态。
它们普遍引发炎症。而衰老细胞的积累会导致代谢紊乱和癌症。
这在许多其他综述中都有引用,但细胞衰老的生物学功能仍不明确。
这个截图来自一个组织的网页,我也是那个组织的成员。
那么,什么是细胞衰老?
它是一种必要的、程序化的稳定细胞周期停滞状态,并伴随着复杂的表型表现。
好,这是观察结果。
衰老细胞在生理过程中发挥作用,如肿瘤抑制、伤口愈合和胚胎发育。
矛盾的是,它们也能促进衰老、癌症和年龄相关疾病。
所以关于这点,我认为并不清晰,没有任何一点是清晰的。
因为你看,癌症被提到了两次,既有正面作用也有负面作用。
所以从这些表述中,我无法完全理解衰老细胞的生物学功能。
2016 年有一篇简短论文提出,细胞衰老是一种先天性抗病毒防御机制。
这是篇好文章,我建议大家都读一读。
它也存在一些缺陷,可能这就是它未能广泛被接受的原因。
长话短说,我们复现了他们的结果。
这里是对照组:A549 细胞;这些是已衰老的 A549 细胞,我们用 GFP 标记的病毒感染它们。
感染后你能看到差异,非常明显。
我们尝试了不同的诱导方式,也就是化学诱导衰老,结果它们都变得抗病毒。
这再次显示出广谱抗病毒效应。
这里显示了属于四个不同家族的五种病毒。
在所有这些情况下,衰老细胞都能抵抗它们。我想Y轴是感染48小时后产生的病毒量。
你能看到所有这些衰老细胞产生的病毒量都减少了。
但不知为何,中间这种诱导方式的抗病毒效果不如另一种。
好的,我们决定用它来寻找机制。
我们对没有病毒的对照细胞进行了实验,
发现大约有16,000个差异表达转录本。
想从这堆东西里找出线索可真不容易。
因为细胞衰老会大幅改变细胞生理状态。
但如果我们只关注在抗病毒探针中被激活的靶点,在这组、那组被激活,而在另一组不被激活
就能把范围缩减到不到 300 个差异表达基因。
它们都富集在干扰素刺激基因和免疫系统中,大部分都是这样。
我们测试了这些干扰素是否确实负责抗病毒功能,负责这种表型。
我们发现确实如此。
所以这项研究再次使用了GFP标记的病毒。
这些是对照细胞。这些是衰老细胞。
在这里我们测试了基因敲除。
如果你敲除IFNAR,也就是干扰素受体,
那么衰老细胞就会积累一些绿色荧光。
如果我们敲除STAT1,即IFNAR的下游,也会发生同样的情况。
这里是野生型,效果非常明显。
如果我们使用 JAK-STAT 通路的抑制剂也是一样的结果,就是STAT1参与的那条通路
看来这些细胞会自行产生干扰素,并在内部激活抗病毒信号。
它们还可以保护周围的健康细胞。
29:31📍 细胞衰老:免疫系统的"民兵部队"还是衰老的罪魁祸首?
我们还发现,如果把衰老细胞的培养上清液加入到健康细胞中,
病毒的复制量也会下降。
这是一个非常基础的结果。先前的论文就已经提出过这一点,因此并非全新发现,我们只是补充了一些机制层面的内容。
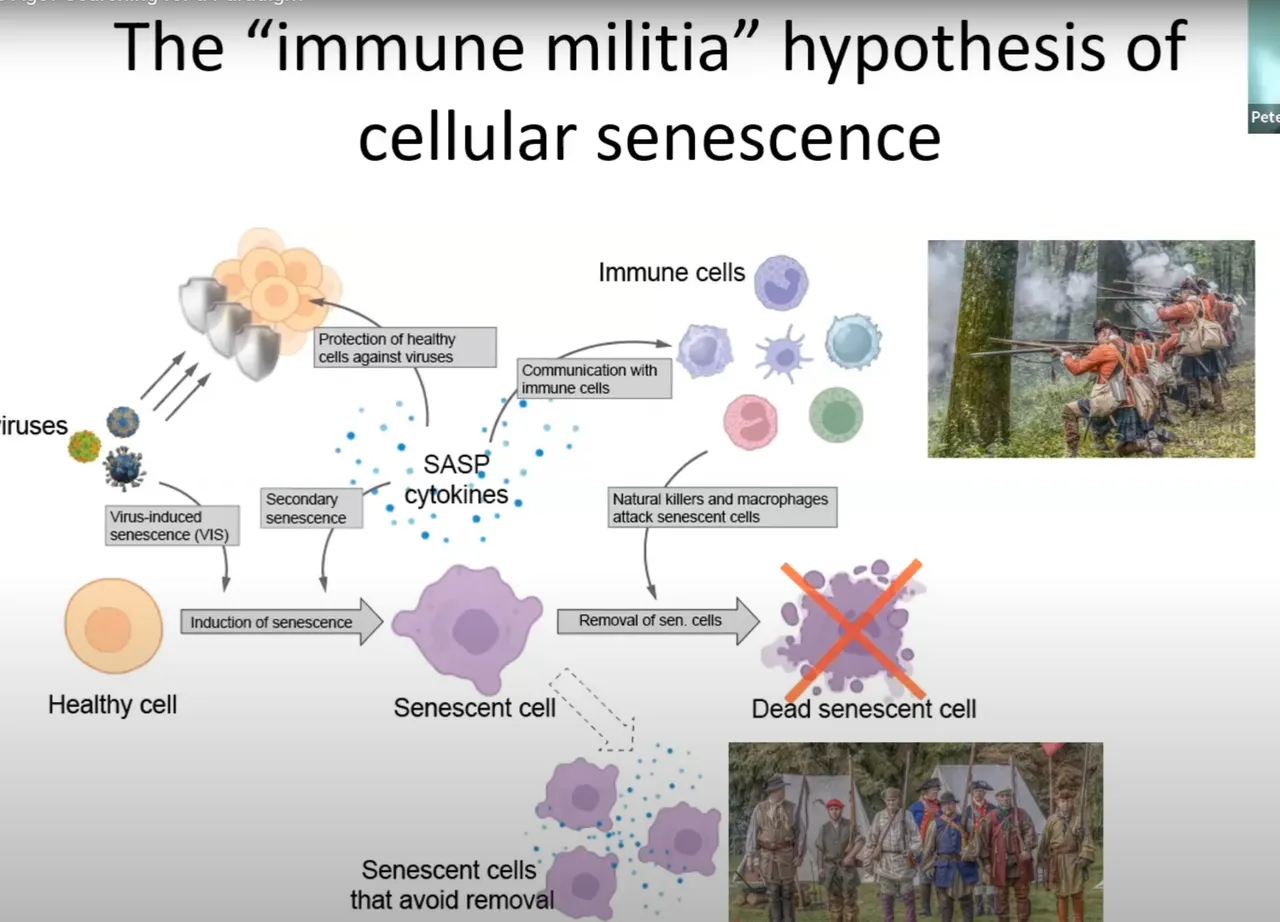
我们目前提出的整体模型,我称之为“细胞衰老的免疫民兵模型”。
这是我对前人理念的一种命名。
核心思想是:病毒可以诱导细胞进入衰老状态。
这些衰老细胞会分泌细胞因子,
这被称为“衰老相关分泌表型”。
这些细胞因子保护健康细胞,与免疫细胞沟通,并介导病毒清除。
在病毒被清除之后,那些仍然可能携带病毒的衰老细胞,应该被恢复到非衰老状态,它们必须死亡。
如果它们没有被杀死,就会开始引发问题了。
所以这支“民兵部队”,我认为这些细胞可以从任何岗位被征召来对抗病毒。
它们执行防御任务,并与“职业士兵”,也就是免疫细胞,进行沟通协作。
而在战争结束之后,它们必须被遣散。
如果没有被遣散,它们就会开始“抢劫”了,也就是引发问题。
这就是所谓的“肺炎假说”。
在此,我要感谢之前在UCSF参与这个项目的所有人
这位是我以前的老板。
这是两位和我一起工作的天才学生。
这是我现在的新实验室。
我很乐意回答大家的问题。
非常感谢,真的非常精彩。
我在聊天框里没有看到问题,
但如果大家想举手提问,我们也可以用这种方式来进行。
好的,Vadim?
你好,谢谢。
演讲很精彩。
我想先讨论一些基础问题,
也就是“程序性衰老理论”与“非程序性衰老理论”的问题。
在我看来,你似乎忽略了大量关于长寿和损伤分子模式的数据。
比如,我们确实观察到突变随年龄积累,
还有各种缺陷、修饰、长寿蛋白、端粒缩短,像是加速了损伤。
我们确实看到了所有这些现象,并且它们都随着年龄而增加。
而你基于不同物种间寿命的差异,就否定了这些。
但我们也在不同物种间看到了规律。
比如说:转录组学、表观遗传学,
已经有很多论文解释为什么不同物种的寿命不同。
然而你却仅仅根据一个例子,也就是裸鼹鼠在年龄增长过程中没有出现死亡率上升,就主张衰老是程序化的。
在这里,我认为你混淆了“死亡率”和“衰老”的概念。
因为器官确实可能会衰老,但这未必表现为死亡率的增加,
因为死亡不仅由衰老引起,
还可能与感染、事故以及其他因素有关。
我们并不知道为什么裸鼹鼠在年龄增长的过程中没有表现出更高的死亡概率,
但它们确实在衰老。
这一点可以通过组学数据和其他特征明确看出,是非常关键的。
在我看来,没有证据表明衰老是被程序化的。
你说从未发现过相关突变体,这确实是事实。
例如在人类中,每个基因都可能发生突变,
但从来没有人因此停止衰老。
这对任何物种的任何个体都适用。
应该有很多这样的例子,
但你所说的这种程序被打破、个体停止衰老的情况,从未被观察到。
在我看来,你提出了一种我们理应能清楚观察到的现象,
但实际上我们从未见到过。
谢谢你的提问。
这个问题很长,但我会尽力回答。
首先,你说你看到了“损伤”。
但你并没有证据表明“损伤”是衰老的原因。
因为如果你去看其他任何疾病,比如感染、糖尿病等等,
你也会发现大量的损伤。
你也能在那些情况下建立“时钟”,看它们如何随时间发展。
我想糖尿病患者的端粒缩短得比非糖尿病患者更快,
但没有人把这两者直接联系起来。
所以其中可能有因果关系,
但可能远没有你想象的那么强。
也就是说,你实际上并不知道什么是主要原因,什么是次要原因。
在我看来,没有科学理由相信衰老是由损伤引起的。
目前的模型和数据,其实可以被不同的理论解释。
第二,你说我否定了“损伤理论”。
“非程序性衰老理论”并不是仅仅基于裸鼹鼠。
我否定它是基于分析论证。
裸鼹鼠只是个例子,表明更长的寿命或几乎不衰老的状态在某种程度上是可以进化出来的。
我认为,这场讨论最终会归结到我们如何定义“非衰老”。
裸鼹鼠在年龄增长的过程中没有表现出死亡率的上升。
从生态学的角度来看,这是否算作“非衰老”?
然后你会说,好吧,它们确实有一些生化层面的变化,
但这些生化变化在进化上是否具有意义?
这个问题我们目前还没有答案。
无论如何,我认为裸鼹鼠是一个非常有趣的例子。
如果你能让小鼠或人类拥有类似的衰老参数,
那将是一个巨大的成功。
我希望我已经大体上回答了你问题。
那我们继续进行下一个提问吧。
我们请 Kris 发言
好的,谢谢。
这是一场非常引人入胜的演讲。
我不是像 Vadim 那样的领域专家,
我只是想多听听你对“拮抗性多效性”理论的批评。
对我来说,真正让我理解衰老的几篇论文是:
Medawar 的《衰老的进化理论》。
Brian Charlesworth 的《衰老与年龄结构种群》。
在生殖期前后阶段之间,存在一个根本性的权衡,
就是生殖期后期缺乏自然选择压力,而生殖期前期存在选择压力。
生殖期的后期,促成你到达那个阶段的基因不会再被传递下去。
而广义上的“拮抗性多效性”是指:
某些在生殖期前期有益的基因,在后期会变得有害。
而且并没有机制阻止这些基因变得有害。
有些有害基因在生殖期前期被抑制,
但过了生殖期高峰之后,这些基因可能会被激活。
我并不认为通过抑制这些基因来逆转衰老有什么冲突,
这实际上是在逆转那些熵增的自然变化。
我的回答是:
你现在把衰老分成了生殖衰老和非生殖衰老,
并且你假设生殖衰老是某种自发发生的现象,
然后再从中推导出体细胞的非生殖衰老,对吗?
但生殖衰老本身也是衰老的一部分,
而且很可能是整体衰老的一个结果。
所以没有理由认为生殖能力应该随着时间下降。
我们面对的是一个包含了生殖和非生殖两个方面的整体衰老过程。
人们把衰老分成两部分,
声称生殖衰老是预先存在的,然后用生殖衰老的预先存在来解释身体其他部分缺乏选择压力以及衰老死亡的现象。
我有回答到你的问题吗?
部分解答了。我认为你说的有一部分我是认同的。
比如我们用老鼠和“有翅膀的老鼠”做个对比,对吧?
普通老鼠的寿命大概是 24 个月左右。
而“有翅膀的老鼠”,也就是蝙蝠——可以飞走躲避捕食者,
它可以在更晚的时间开始繁殖,
而且寿命可以达到 20 或 30 年。
所以这里存在一种进化力量,
让蝙蝠比老鼠拥有更长的繁殖能力持续时间和性选择优势。
是的,外源性死亡率对衰老的影响是一个争议很大的话题。
你可以去看看我的推特,我们讨论过这个问题。
但这个问题非常具体。
很多人不相信这种影响存在。它没有直接影响。
可能通过改变繁殖时间表产生间接影响,
但外源性死亡率与衰老之间没有直接关联。
此外,其他“有翅膀的老鼠”——比如麻雀,
麻雀的死亡率其实非常高,
每年大约有 50% 的麻雀会死亡。
但它们依然能活得比较长,
在野外的寿命更像是普通老鼠的寿命水平,
而且它们仍然能产很多蛋,
而且持续产蛋的时间也很长。
所以这明显是一个反例。
我完全看不到“生殖能力随时间下降”这一点有任何合理的解释。
好吧,假设我是个动物,
而和我同龄的 99% 的个体都已经死了,
那我为什么非得死?
这怎么可能是一个好的进化策略?
相反,我应该利用这个机会来繁殖。
而这已经被数学模型形式化表达出来了。
我不确定我的演示文稿里有没有这部分的幻灯片,
但你完全可以去我的推特查看,或者给我发邮件。
现在我手头没有资料,
你可以去找 Dan Promislow,他可能更合适。
还有 Hal Caswell,他们做过这方面的数学建模。
你也可以参考 David Reznick 的研究,
他展示了更高的死亡率会导致衰老速度变慢 ——
不是说寿命更长,
而是在生理层面上衰老变得更慢。
如果你给我发邮件,我可以把参考资料发给你。
我不确定自己是否全面回答你的问题,
但我至少尽力了。
好的,全面且部分令人信服,谢谢。
很好,谢谢。
下面我们有请Moritz
谢谢你的演讲,Peter。真的很棒。
对我来说,衰老是适应性的这点也很明确。
我觉得这是生命的一个重要特征,
而如果进化并没有对它进行优化,那听起来就太荒谬了。
所以我可以说,我真的很确信衰老具有适应性。
所以我非常相信它是适应性的。
我读到的最好、最简单的解释
是在一篇2011年的论文里,我刚查了一下,叫:
《变化与衰老:细胞衰老与适应》。
基本上,作者做的是:他对几种物种进行了建模。
设想是这样的:相同的物种,在一个不断变化的环境中,一个死亡,另一个不会死亡。
结果是——在成千上万次的模拟中,带有衰老机制的物种总是获胜。 为什么?
因为随着时间的推移,这些会衰老的物种更能适应不断变化的环境。
所以基本上,在变化的环境中,如果你会死,你比不衰老、不会死的版本更适应环境
即使那是同一种物种,只是版本不同——一个会死,一个不会死。
这对我来说非常合理。我觉得这比你提出的涉及病原体的论证更简单。
在我看来,病原体可能是这个机制的下游因素。
它们当然也说得通,这个逻辑我也能理解。
但为什么要在这个模型中引入病原体呢?
好问题,我刚才在找另一篇论文,我记得它是去年发表的,提出了一个更好的模型,但核心想法是一样的。
问题在于,如果你仔细看看这些模型到底模拟了什么,
它们都假设环境变化非常快
快到父母根本无法适应孩子将要生活的环境。
此外,大多数模型不包括有性生殖。
而实际上,在大多数有性生殖的物种中,
长寿和新获得的适应性特征会很快就会通过基因重组整合,
所以很快就能出现同时拥有新适应性和长寿的个体。
第三,这种模型与我们在自然界中的观察并不吻合。
比如我们说到真社会性昆虫时,
从事繁殖的群体寿命更长
但照理说,为了维持变异性,它们应该寿命更短。
另外,如果增加遗传漂变,也会损害变异性。
如果加快世代更替的速度,
可能会丢失那些在未来进化中至关重要的稀有变异。
所以因为保持遗传变异非常重要,
如果我们只偏好那些在当下适应性最强的个体,
就可能会失去未来真正需要的那一部分。
再看那些长期以来几乎没有发生进化的动物,
比如鲨鱼、蝌蚪、虾,或者这些蝾螈,
还有自从希克苏鲁伯撞击事件以来在 6600 万年间基本保持不变的哺乳动物,
我们并没有发现它们具有很长的寿命。
所以看起来它们并没有在这方面进化得很好。
我觉得我还有其他论点可以列举,
但目前这些已经足够了。
我可以把那篇论文发到聊天框里。
好的,谢谢。
我看目前最后一位举手的是 Kent,有请你发言。
嗨,Peter,很棒的演讲
我很好奇你的实验室工作。
在你的研究中,实验操作相比数据分析,哪个更是瓶颈?
你是否对动手做实验感到沮丧,还是这些实验操作并没有拖慢研究进度?
不,我是受过实验训练的病毒学家
整个疫情期间我都在 BSL-3 实验室里开心地做实验。
所以我是一个实验操作研究员。
所以,不会觉得厌烦,反而是非常有趣的。
我认为这项工作对细胞衰老领域来说非常重要,也很有意义。
只是我觉得它不是那么具有普遍性,
而且, 我是在验证一个别人提出的模型,
这可能是我表现得不那么热情的原因。
我想你可能误解了我的问题。
我之前不知道你实际上依然花很多时间在实验台上,
我现在知道了,这很不错。
但现在还需要做很多亲自动手的实验吗?
我自己已经有 20 年没有全职做过分子生物学实验了。
我只记得那个过程很难、很慢、很枯燥。
我想知道现在还是这么痛苦吗?
这些实验工作会拖慢你的进度吗?
还是说比起实验技术和仪器本身,还有其他更大的障碍?
不会,任何事情如果你不喜欢,或者它没有正反馈,又或者你有其他更有趣的事情要做,那它自然会让人感到厌烦。
不过现在我有学生帮我干活了。
所以你现在有学生给你干苦活儿了,
就不像以前那样抱怨那么多了。
我只是想问你,
有没有什么你想做但因为资源有限而无法达到的实验规模?
如果你有无限多用于实验的猴子或给你干活的学生,
有什么是你现在做不了但想做的?
这是个很好的问题。
我可能会在免疫系统方面投入更多。
因为我认为免疫系统的变化是关键所在。
我认为在我们有生之年让人体重返年轻,至少在某种程度上,最好的路径就是重塑免疫系统。
所以我会选择那个方向。
我目前研究衰老细胞,是因为它更容易入手,
在有限的资源、
有限的时间内,
更符合我的专业背景。
如果我拥有更多资源,
我会深入研究免疫系统。
如果你是投资人,你会投资抗清除衰老细胞疗法吗?
还是你认为那些注定会失败?
是的,我会投资。
好的。所以你认为清除衰老细胞是个好方向,
即使衰老细胞有很多重要的功能?
我认为衰老细胞的重要功能是在它们被诱导后短时间内发挥的。
这不只是我的观点,我也问过这个领域的其他专家,
他们也这么说。
下一个提问的是Madi。
嗨,Peter,谢谢你。
我很好奇宿主因感染而缩短寿命的其他情况,
这些情况可能不如“单次繁殖”那样极端,
但可能出现在并不具有真社会性的物种中,
或者是在感染不那么严重的情况下发生。
在这些情况下,
你会如何区分以下两者的影响:
一方面是病原体感染的直接后果,另一方面是宿主产生的反应导致的间接效应
后者可能是为了减轻病原体对包容性适应度的影响?
是的,这确实是个很好的问题。
我们已经知道,慢性感染会加速衰老时钟。
例如 HIV 和慢性肝炎,
它们都会加速衰老。
这完全符合我们的模型,
因为如果动物“意识到”自己患有慢性感染,
这可能就是一个信号,提示它应当更早死亡。
但关键在于,如今普遍认为,即使不是由病原体引起的慢性炎症,
也会对寿命和健康寿命产生负面影响。
这种慢性炎症会导致衰老的各种症状, 或者加速它们的出现。
对于感染情况,你可能会希望分析哪些免疫通路被激活了,然后对这些通路进行诱变处理,
再感染这些小鼠,观察感染是否仍然发生。
这是个很复杂的实验,因为这些通路中的免疫基因仍可能影响感染本身。
所以也许可以做,但它是一个实验,不是一件简单的事,
但目前可以确定的是,如果我们用遗传工具激活炎症,比如在动物体内激活炎症,那么它们的衰老速度会加快。这是众所周知的。
也就是说,免疫系统确实可以加速衰老,
我认为这是事实。
所以我们没有更多问题了。
Vadim,你想继续讨论吗?
我想我也许还可以再补充几点。
我可能有些批评的观点,请见谅,我可能错了,甚至完全错了。
但在我看来,你不仅混淆了衰老和死亡率,
还混淆了衰老和寿命。
所以当我们讨论衰老的进化时,
我们应该讨论的是从“不会衰老的物种”过渡到“会衰老的物种”这一过程的进化,
而不是单纯地讨论寿命的长短变化,例如寿命变长或变短,这些可能是适应性的,
但这并不意味着“从不衰老状态演化到衰老状态”本身是适应性的。
即便这个过程是适应性的,也不代表它是被“程序化的”。
比如说,我们在进化中发展出了大脑,
大脑由不可再生、完全分化的细胞构成,
有些细胞会随时间丢失。
所以,当你进化出一个大脑时,
你就在某种程度上注定会衰老,对吧?
但这不是“适应性的衰老”。
你进化出大脑是为了获得神经功能,
衰老是这个选择带来的一个副作用。
所以不是说我们为了衰老而进化出大脑。
所以这个逻辑对我来说有点不对。
还有类似的情况。
比如说多效基因,你说没人展示过多效基因的例子,
所有模型,像Williams和Medawar的模型,都基于熵因子,
这也不对。
好吧,我认为那些相信衰老是由损伤造成的人,
他们的观点来自对 Medawar 和 Williams 的理论分析,
但如果真正仔细阅读他们的论文,这种观点就会改变。
比如,我不同意 Medawar 和 Williams 的观点,
但我仍然认为衰老是由损伤引起的。
很多人都这样认为。。
因为多效性,每个基因都有功能。
它们完成各自的作用,对吧?
但与此同时,在它们发挥功能的过程中也会产生损伤。
比如突变,AP突变,
又比如代谢过程中的副产物——这些都是会发生的。
所以每个基因都具有两个特征:一个是正面的功能,另一个是负面的损伤,
所以没人展示过任何多效基因吗?
没人展示过...不,我不是那个意思。
我的意思是,具有一好一坏两种功能的基因已经被发现了。
但要让“拮抗性多效性”理论成立,仅此还不够。
必须要存在这样一种基因,它的两种功能在进化中无法分离。
这才是关键所在。
因为这意味着什么?
比如说,老鼠因为某些多效基因而死亡,
但松鼠的寿命却是它的五倍。
那这是否意味着松鼠是因为完全不同的基因组而衰老?
还是说那些多效基因的负面效应
在松鼠体内以某种方式被抵消了?
而“损伤积累理论”,在解释这类问题时,尤其站不住脚。
还有,关于大脑,Vadim,
自从我们与黑猩猩分化以来,已经过去大约七百万年。
在这七百万年里,
我们首先进化出了更好的大脑,也许只是略有提升,
但我们的寿命却翻倍了。
所以两者同时进化并不存在矛盾。
你说我们因为大脑而衰老,这并不正确。
通常,大脑更大的动物寿命更长,
虽然不是全部,但大体如此。
越聪明的物种越倾向于采取 K-选择策略,
而这通常与长寿相关。
我想我漏听了问题的第一部分,你刚才问的是什么?
我的例子是想说明:
你把“从非衰老到衰老的转变”与“寿命”混为一谈了。
你刚才的回答里,你又一次把这两个概念混淆了。
所以,这是一个复杂的讨论和观点输入。
确实,在我的模型中,
我真正关注的是寿命,
因为这是流行病学模型中的参数。
衰老更像是这种寿命调节的机制核心。
我现在还没准备好回答这个问题,
因为我需要稍微转换思路来更好理解。
我担心如果我现在就开口,
会说得不清楚——
我需要思考一下。
如果你能写下来,
把问题正式地表述出来,
我会尽力回答。
我想今天的讨论就到这里啦。
非常感谢大家提出这么多精彩的问题,
也特别感谢 Peter 教授参与我们的系列讲座!
不管你现在身处世界的哪个角落,祝你拥有一个愉快的晚上、早晨或下午,
也祝大家度过一个愉快的一月!
我们下个月再见,拜拜!
——
延伸阅读
- The Evolution of Aging
- Could aging evolve as a pathogen control strategy?
- Is Aging an Inevitable Characteristic of Organic Life or an Evolutionary Adaptation?
- Cell senescence is an antiviral defense mechanism
——
No comment
00:00
/ 52:23